Protocolo de coleta de amostras para eDNA metabarcoding usando filtros Sterivex - LGC PUC Minas
Gabriel Antônio Mendes, Guilherme Costa Berger, Heron O Hilário, Daniel Cardoso de Carvalho
Abstract
O objetivo deste protocolo é orientar sobre a coleta de amostras de água para empregar a técnica de DNA ambiental (eDNA) metabarcoding. Nesta metodologia empregamos os filtros Sterivex, que permitem uma filtragem no local de coleta, com fácil manuseio, menor risco de contaminação e uma melhor preservação de DNA ambiental nas amostras.
Este protocolo foi desenvolvido pelo Laboratório de Genética da Conservação - PUC Minas, e está em constante aprimoramento.
Conheça nosso grupo e linhas de pesquisa: https://sites.google.com/view/lgcpucminas
Before start
Preparação
Primeiramente, certifique-se de realizar a coleta e a filtragem em um ambiente aberto e plano. Se possível, utilize uma superfície esterilizada para apoiar o kit de coleta e seus componentes durante os procedimentos. Após a filtragem e armazenamento das amostras, lembre-se de recolher os descartáveis para efetuar seu descarte adequado. Se possível, realizar os procedimentos em dupla.
Steps
Preparação
Primeiramente, certifique-se de realizar a filtragem em um ambiente aberto
e plano. Se possível, utilize uma superfície esterilizada para apoiar o kit de coleta e
seus componentes durante os procedimentos. Após a filtragem e armazenamento das
amostras, lembre-se de recolher os descartáveis para efetuar seu descarte adequado. Se
possível, realizar os procedimentos em dupla.
O kit de coleta é composto pelos seguintes materiais:
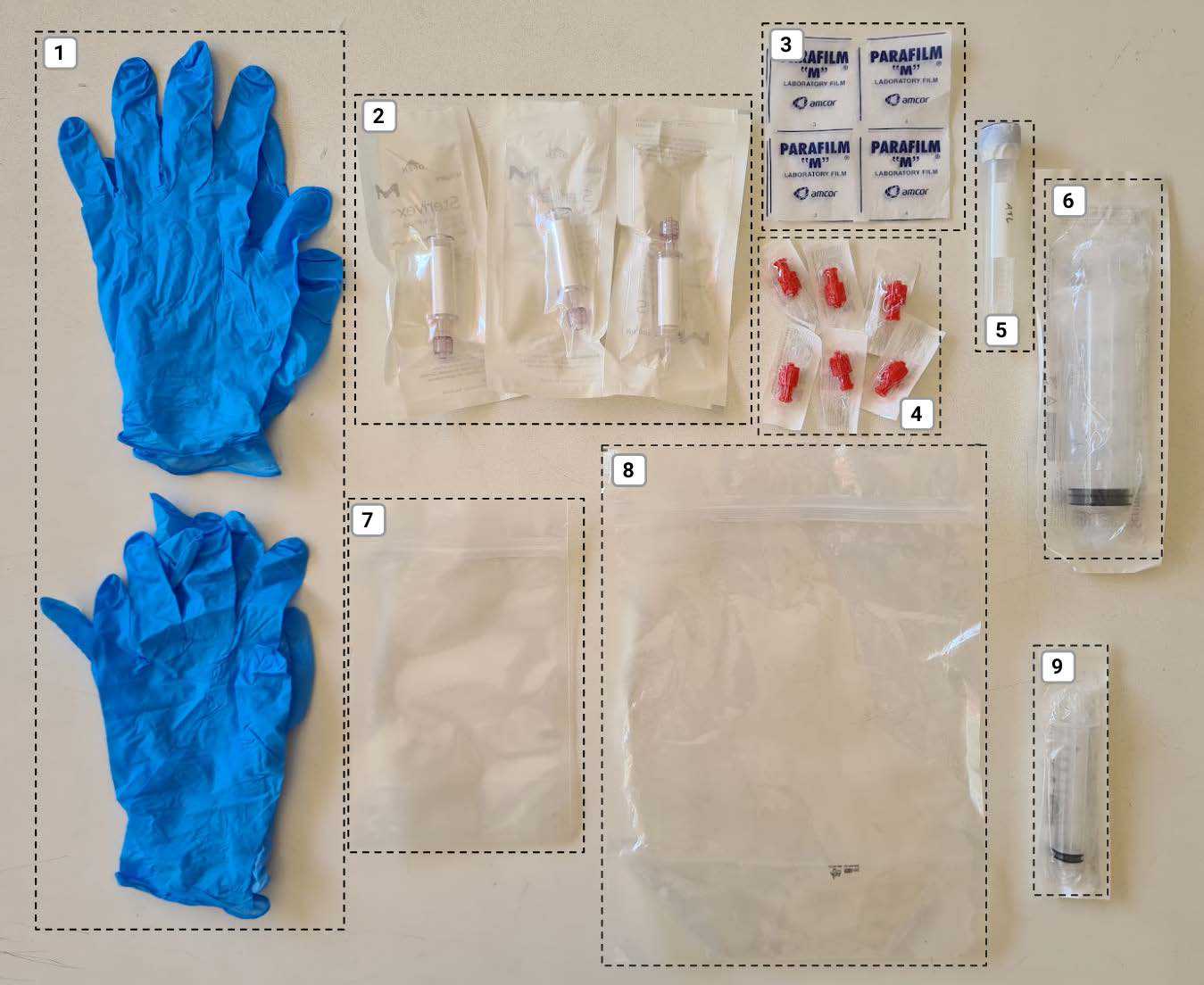
- Dois pares de luvas
- Três filtros Sterivex
- Três pedaçosde filme plástico Parafilm
- Seis tampas Luer Lock
- Tubo falcon contendo solução tampão ATL
- Uma seringa descartável de 60ml
- Um saco Stand up pequeno
- Um saco Stand up grande
- Uma seringa descartável de 10ml
Coleta
Abra o kit com cuidado e colque um par de luvas para começar a coleta. Evite tocar na superfície externa das luvas.
A coleta da água pode ser feita diretamente através da seringa (1A), caso seja um local seguro para o coletor e sem o risco de contaminar a água a ser filtrada. Também é possível realizar a coleta utilizando o saco Stand Up grande (1B e 1C). Se houver muito sedimento em suspensão na água, aguarde alguns momentos para que estes decantem e proceda com a filtragem.

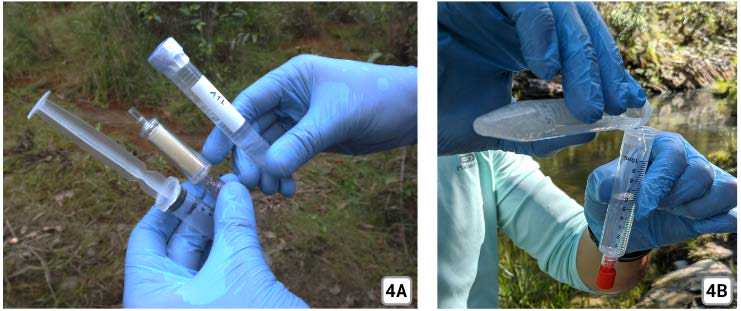
Encaixe o Sterivex na Seringa (2B) utilizando o encaixe de rosca luer lock (2C).
Passe a água pelo Sterivex pressionando o êmbolo da seringa (2D). Esse processo deve ser repetido quantas vezes for necessário. 1 passagem = 60ml de água. Se a seringa ficar obstruída e o êmbolo travar, puxe levemente o êmbolo para remover particulado do filtro, e retome o processo. Evite passar ar pelo filtro, apenas água.

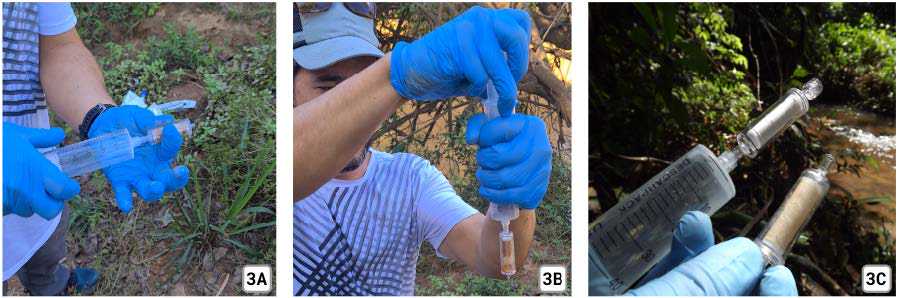
Após filtrar a quantidade total planejada, desencaixe a seringa do filtro e puxe o êmbolo para a posição inicial, preenchendo a seringa de ar (3A). Encaixe a seringa novamente no Sterivex e aperte o êmbolo, passando o ar pelo filtro Sterivex (3B). Repita esse passo até retirar toda a água do filtro. Este passo é muito importante para garantir a conservação da amostra.
Conservação das amostras
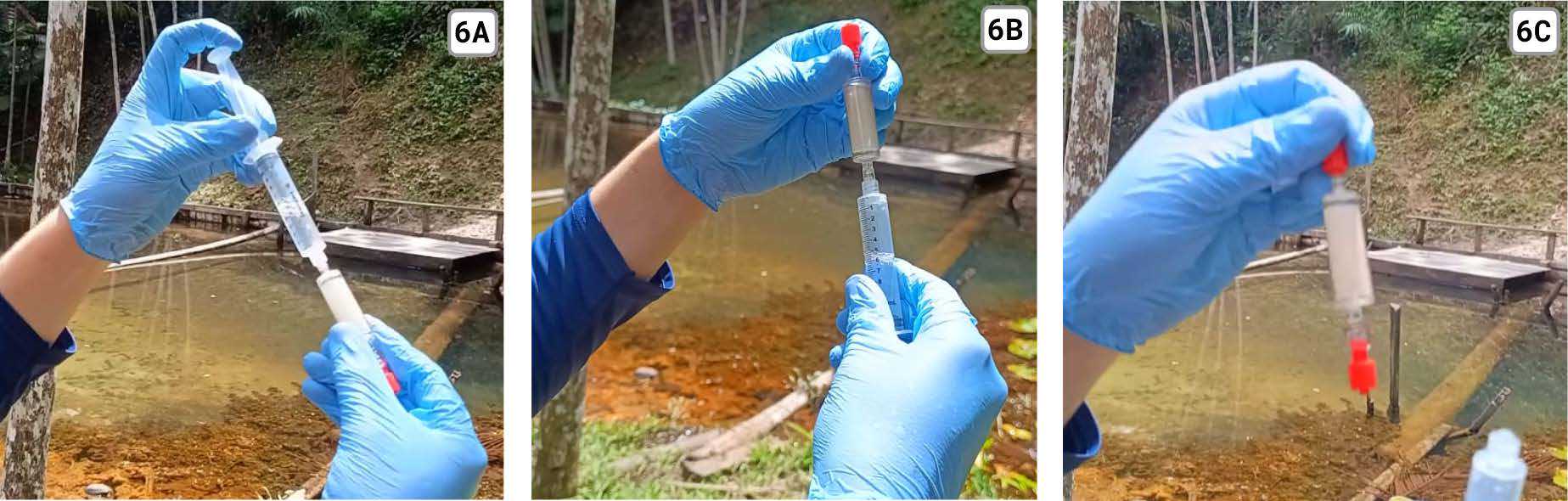
Após a filtragem, é necessário colocar o tampão ATL para conservar o material genético contido no filtro. Primeiro abra a seringa de 10ml, remova o êmbolo e encaixe uma das tampas Luer Lock de cor vermelha na saída da seringa.
Cuidadosamente, recoloque o êmbolo na seringa. Com a seringa voltada para cima, retire a tampa Luer Lock . Em seguida, encaixe o filtro Sterivex que já foi utilizado na filtragem.
Se o kit contém o Sterivex com apenas uma saída Luer Lock (5A), utilize um pedaço de Parafilm ou de papel-filme para obstruir a saída enquanto coloca o tampão. Esse mesmo papel pode ser utilizado na vedação final da amostra.
Caso seja o Sterivex com duas saídas Luer Lock (5B), feche a saída com uma tampa Luer Lock.

Repita os processos descritos acima para cada uma das replicatas biológicas coletadas em campo.
Observações
Uso de amostras de controle de contaminação da filtração: estas amostras têm como objetivo garantir que não há contaminação intrínseca ao sistema de coleta. A filtragem destas devem ser feitas em um ambiente limpo, utilizando água ultrapura (em experimentos com microorganismos), ou mineral (no caso de experimentos com vertebrados). Estas amostras devem ser extraídas, sequenciadas, analisadas e, caso apresentem ASVs/OTUs, as mesmas podem/devem ser excluídas das demais amostras.* Volume de água: O volume a ser filtrado em cada filtro (replicata) deve ser padronizado em todos os pontos amostrais. Recomendamos no mínimo 3 passagens de 60ml, mas pode variar devido a qualidade da água, podendo ser decidido pelo pesquisador no momento da coleta se o volume filtrado será maior.