Nature、Cell连发的多个基因编辑新工具/技术,有何厉害之处?
人类基因组超过一半由重复序列组成,一些重复序列在疾病发展中起着有害作用。研发一个能够在各个尺度上模拟扩增并生成重复序列的高效可编程系统,有助于促进对重复序列功能和潜在机制的研究。
2024 年 6 月 26 日,武汉大学在 Cell 发表研究,开发了名为扩增编辑(AE)的基因组编辑工具。同一天,国外团队在 Nature 也同时发表了两篇研究,描述了一种名为双特异性桥接 RNA 的新型基因组编辑技术。

在Cell 研究中,科研团队开发了名为扩增编辑(Amplification Editing,AE)的基因组编辑工具,能够在染色体尺度上实现可编程的 DNA 复制。AE 能够以可编辑的方式精确高效地复制从 20 bp 到 100 Mb(与人类染色体相当)的基因组序列,效率可达到 73.0%,极大地扩展了编辑碱基的尺度。
AE 在多种细胞类型(二倍体、单倍体和原代细胞等)中都表现出活性。AE 能够在胚胎干细胞中创建疾病相关区域的染色体微重复。该研究开发的 AE 是一种精确高效的染色体工程和 DNA 复制工具,首次将精确基因组编辑的范围从单个遗传位点扩展到染色体尺度。

扩增编辑(AE)的原理是什么?为了复制感兴趣的序列,研究者设计了一个 Cas9 缺口酶-逆转录酶融合体(PE2)和一对 pegRNA。感兴趣的序列在两端被 Cas9 缺口酶缺口,先导编辑的引导 RNA(pegRNA)的反转录酶模板(RTT)被设计成产生两个互补的序列片段。这些片段退火后,以两个缺口之间序列的一条链为模板,启动 DNA 合成。感兴趣的序列被精确复制,中间插入一个小序列。这种基因组编辑即 「扩增编辑」(AE)。
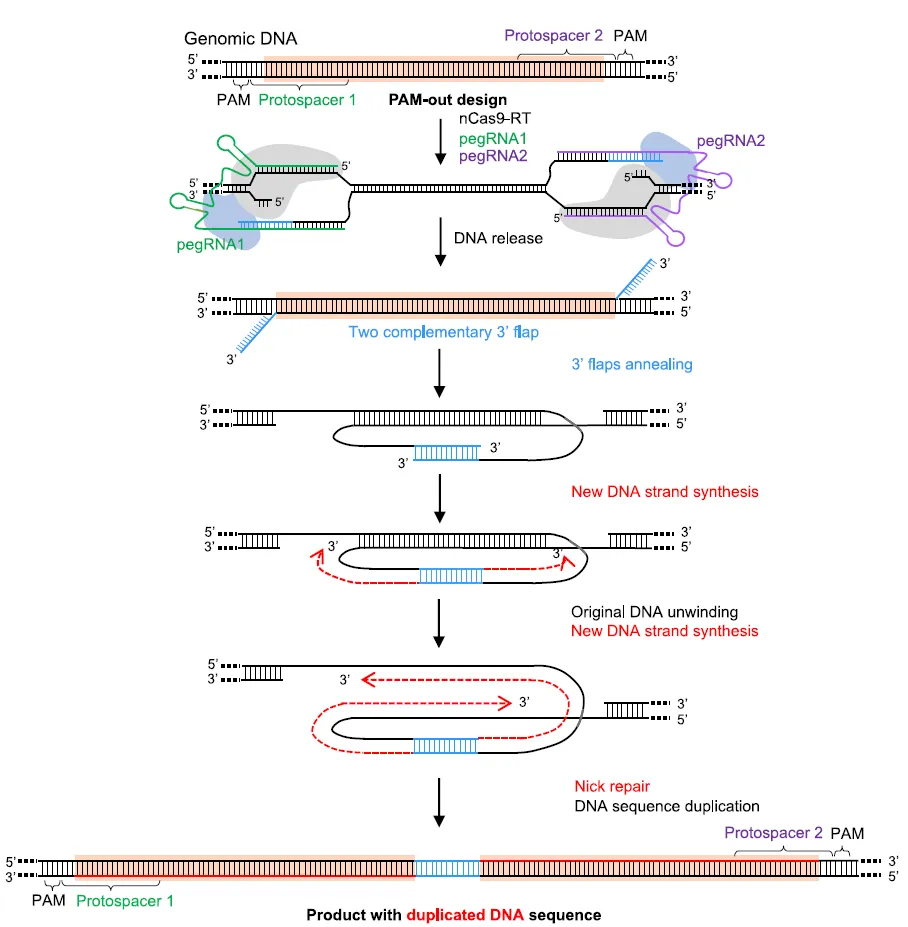
图 2 扩增编辑(AE)的原理(图源:[1])
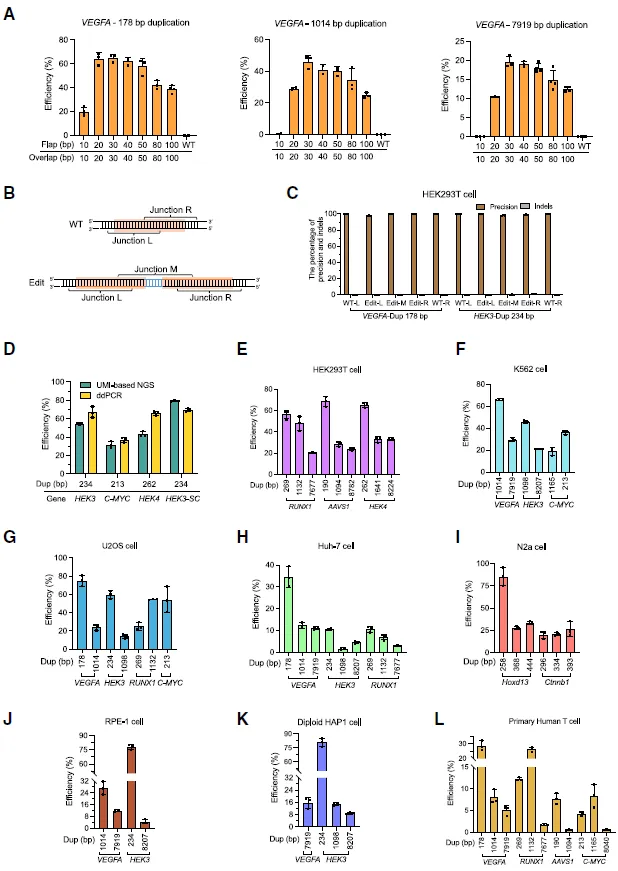
图 3 扩增编辑(AE)在不同细胞系的表征优化(图源:[1])
如何确认扩增编辑(AE)的效果?通过长线程测序、Southern 印迹和单细胞克降分析 AE 数百个碱基对到千碱基量级的扩增结果。
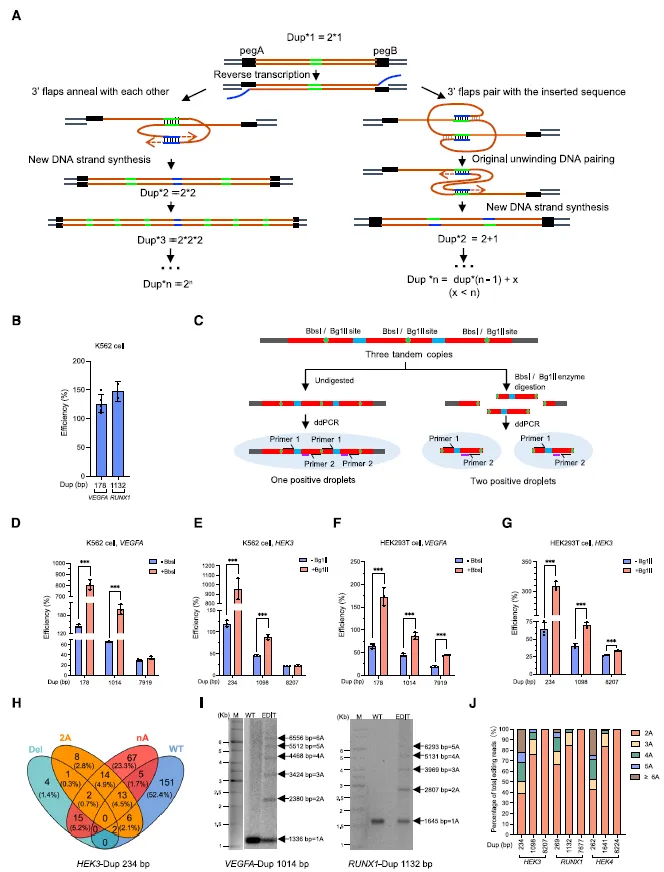
图 4 扩增编辑(AE)介导多轮扩增(图源:[1])
扩增编辑(AE)的特点是什么?研究者证明 AE 可复制从 20 bp 到 100 Mb 尺度的基因组序列。AE 复制 1 Mb 的效率高达 >70%,并能在各种细胞类型中有效发挥作用,包括人 HEK293T、K562、U2OS、Huh-7、小鼠 N2a、人二倍体系 RPE-1、HAP1 细胞、原代人 T 细胞、mESCs、hESCs 和 haESCs。AE 复制 100 Mb 序列的能力是以前的方法无法实现的。AE 是一种精确、高效的染色体工程工具,可用于生成复制序列,将精准基因组编辑的范围从单个基因位点扩展到染色体范围。
使用 Cas9 核酸酶或 Cre 重组酶进行的「复制 」是反式等位基因重组,姐妹染色单体的拷贝被破坏,不会增加细胞的总拷贝数,而且效率低下。与此相反,AE 利用一对 pegRNA 高效、精确地实现长程复制。

肿瘤细胞模型 C-MYC 基因是肿瘤发生和发展的关键驱动因素,它的拷贝数在各种癌症中都会增加。作者发现 AE 能在多种细胞系(包括肿瘤类型)中扩增 C-MYC 区域。AE 可用于生成细胞或动物模型,以研究基因扩增在癌症和其他疾病中的作用。作者证明 AE 可在 hESC 和 mESC 中诱导疾病相关区域的 Mb 级扩增。AE 可以通过将编辑过的 mESCs 显微注射到囊胚中来创建小鼠模型。AE 为高效创建具有染色体重复特征的多种细胞和小鼠模型提供了方法。
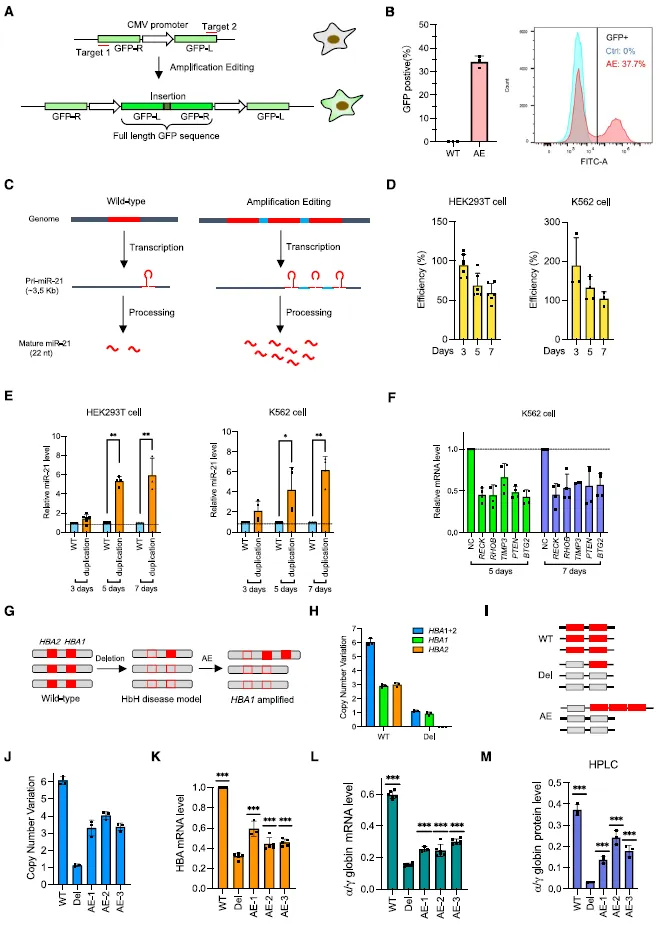
图 5 扩增编辑(AE)构建细胞模型(图源:[1])
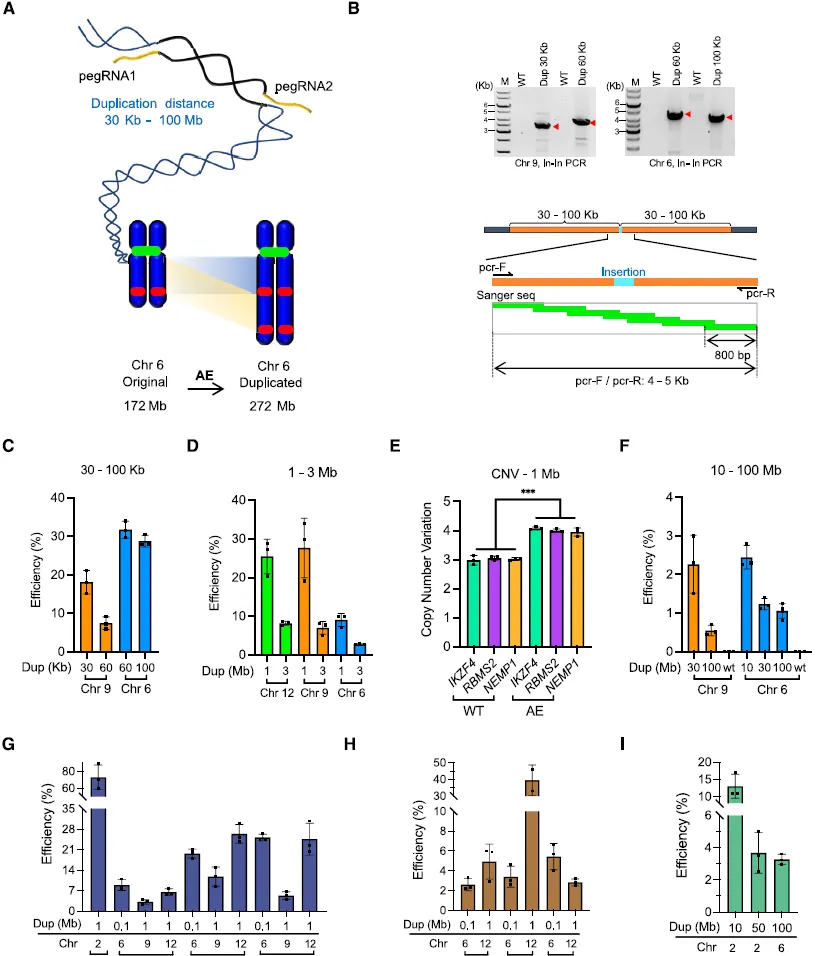
图 6 扩增编辑(AE)实现染色体水平扩增(图源:[1])
该研究有什么局限性?在神经元等非分裂体细胞中大部分遗传和基因组疾病都倾向于发生突变校正。AE 对细胞周期的依赖性限制了它在这些细胞中纠正染色体局部缺失的治疗应用。研究表明,AE 能在不分裂的初级皮质神经元中实现部分扩增,但不能实现较大的或 Mb 级的扩增。这可能是由于 AE 中使用的反转录酶促进了小型复制,而大型复制可能需要内源性 DNA 聚合酶。
尽管如此,AE 的 DNA 复制和大规模染色体工程能力使其成为生物研究和疾病建模的重要工具,AE 还可应用于祖细胞和干细胞的潜在治疗。总之,AE 能精确高效地复制基因组序列,为基础研究提供了强大的基因编辑平台。AE 基因组编辑工具不仅能修改单个基因座,还能在大范围,甚至染色体级别内进行精确编辑。

此外,Nature 于 2024 年 6 月 26 日发表的两篇研究,描述了一种新的基因组编辑技术,这种技术能在用户指定的基因组位点插入、倒位或删除长 DNA 序列。能实现这些基本 DNA 重排的单步法或提供一种更简易的基因组编辑方法。该方法或比现有技术更有优势,比如有望比现有技术进行更精准有效的大规模基因组编辑,以及能介导重组而不是造成需要修复的断裂。

Nature 第一篇论文 Bridge RNAs direct programmable recombination of target and donor DNA 中,Patrick Hsu 实验室描述了一种将可编程重组酶用于基因编辑的技术,在可移动遗传元件(Mobile Genetic Elements,MGEs)IS110 重组酶家族中发现了一种全新的双特异性桥接 RNA。这个桥接 RNA 含有一个指定供体 DNA 序列的区域以及另一个指定基因组插入位点的区域。这两个区域都能通过独立重编程识别并结合不同的 DNA 序列或插入位点,并对不同类型的 DNA 重排使用一种通用机制。这个桥接 RNA 比使用常规重组酶的现有基因编辑技术更易修饰,现有基因编辑技术需利用更复杂的蛋白质-DNA 结合位点。
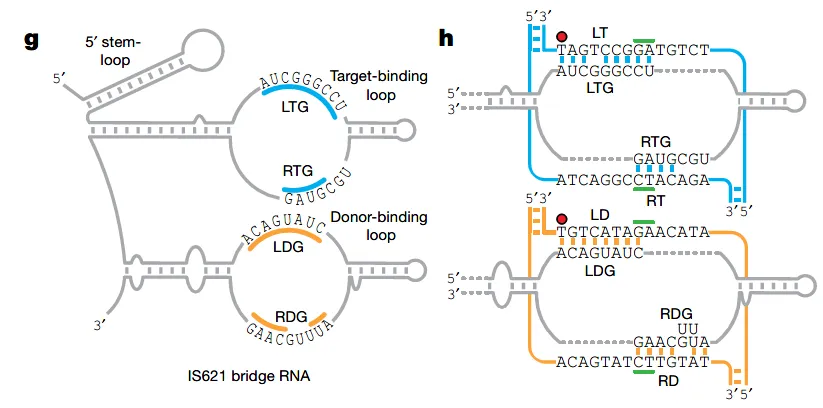
图 7 桥接 RNA 结构及作用机制(图源:[2])
在另一篇同时发表的论文 Structural mechanism of bridge RNA-guided recombination 中,西增弘志(Hiroshi Nishimasu)实验室用冷冻电镜解析了这种重组酶的结构,对其作用机制进行了详细概述。

随着进一步的探索和发展,桥接机制有望迎来第三代 RNA 引导系统,超越 CRISPR 和 RNA 干扰(RNAi)的 DNA 和 RNA 切割机制,为可编程的 DNA 重排提供统一的机制。对于哺乳动物基因组设计桥重组系统的进一步发展至关重要,桥重组酶在不释放切割 DNA 片段的情况下连接两条 DNA 链,从而避开了当前最先进的基因组编辑技术的一个关键限制。「桥重组机制解决了其他基因组编辑方法面临的一些最根本的挑战」 研究联合负责人 Durrant 说。「可编程地重新排列任何两个 DNA 分子的能力为基因组设计的突破打开了大门」。