无细胞蛋白质表达系统中,环状单链 DNA 载体的应用!
无细胞蛋白质表达(CFE)系统已成为体外工程和设计生物系统的一种替代平台,可高通量药物筛选、即时诊断和生物制造。在 CFE 系统中,蛋白质表达的载体通常是环状双链 DNA 分子(如质粒)或线性双链 DNA。这些 DNA 双链通过转录因子来调控转录,从而成为 DNA 和 RNA 聚合酶依赖性的载体。

目前,虽然调控双链DNA表达的方法相对较少,但通过调整转录因子对双链 DNA 的识别和结合已实现了可切换的分子装置。与此相比,基于 RNA 的 CFE 系统越来越受到关注,因为RNA具有丰富的二级结构且可通过操纵杂交和链置换反应来控制。
其中,核糖开关和立足点开关(toehold switch)是最具代表性的RNA类型,允许通过DNA或RNA序列或其他靶分子触发的结构转变来激活或抑制基因表达,但RNA在溶液中的降解和稳定性问题仍然存在。

近日,《Nature Communications》刊登了一篇研究文章,开发了一种可编程的载体——环形单链DNA(Circular single-stranded DNA, CssDNA),其源自 M13 噬菌体,能够被 DNA 和 RNA 聚合酶处理,在基于酵母提取物的 CFE 系统中有效表达蛋白质。

『 01 』CFE 系统中 CssDNA 的基因表达
具体来说,他们将噬菌体载体 pScaf-7560.1 质粒经 Kpn I 和 BamH I 消化,获得包含一个用于 ssDNA 起始的 M13 起点和一个用于终止的突变 M13 位点。随后通过无缝克隆—Gibson组装,将目的基因与pScaf骨架连接,经过测序验证后,在DH5α感受态中扩增。
为了得到 CssDNA,将M13辅助质粒与上述重组pScaf质粒共转化XL1-Blue菌株,摇床过夜后,收集上清中的噬菌体并裂解,得到 CssDNA(图1)。
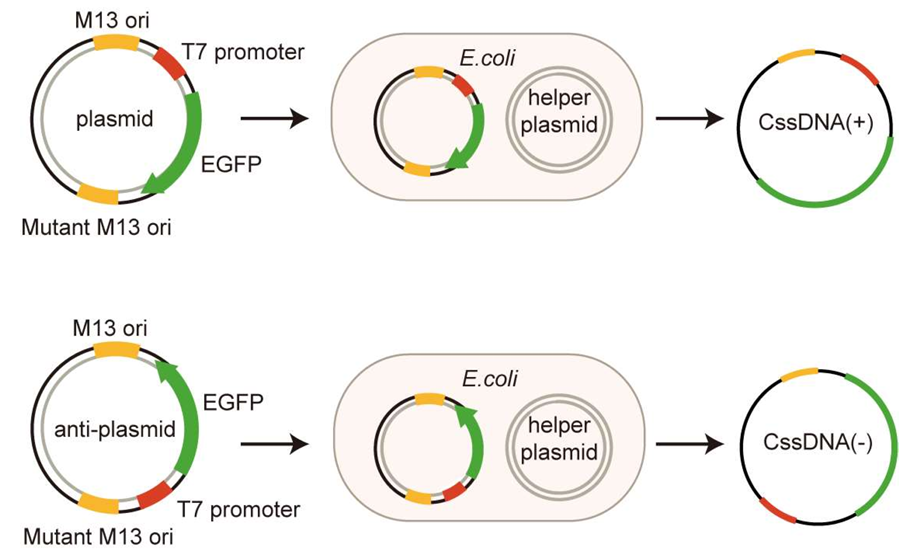
图1 环状单链DNA的噬菌粒生产示意图,有义/反义质粒的特征,以及相应的CssDNA
为了评估 CssDNA 载体在 CFE 系统中的性能,他们设计了两种类型 CssDNA,都包含 T7 启动子和 EGFP 编码区,其中 CssDNA(+) 编码 EGFP 正义链(图2a,左),而 CssDNA(−) 包含 EGFP 反义链的互补序列(图2a,右),序列如下。

随后,使用琼脂糖凝胶电泳和原子力显微镜(AFM)对 CssDNA 进行了表征,并与相应的质粒进行比较。如图 1b所示,CssDNA 泳道(1605 nt)显示的凝胶带,表明 CssDNA 产物的纯度很高。
CssDNA 的 AFM 图像显示卷曲的结构类似于毛线球,而质粒的结构看起来更拉伸,这是因为单链 DNA 具有高灵活性(图2c)。
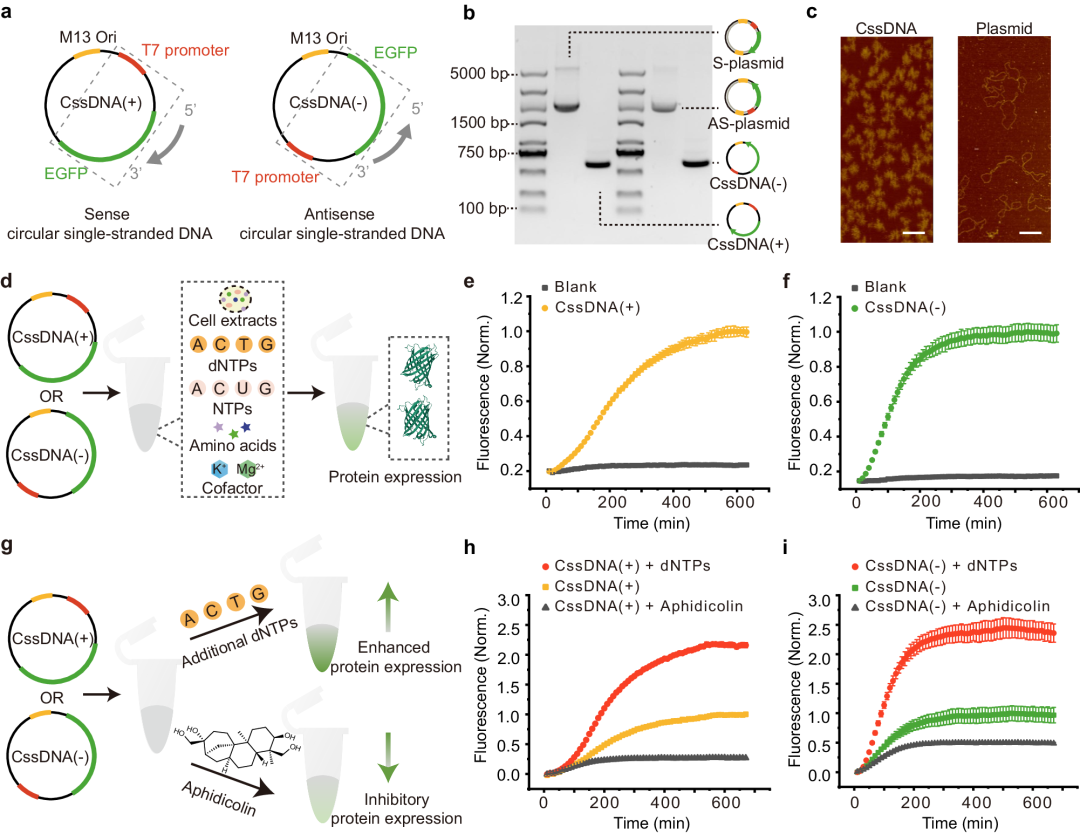
图2 CssDNA的表征及其在 CFE 系统中蛋白质表达的调控
之后,他们检测了基于酵母提取物的 CssDNA 蛋白表达和 EGFP 荧光强度。结果显示,无论是CssDNA (+) 还是CssDNA (-) 基因载体,在CFE系统中都可以有效表达目标蛋白(图2d)。
此外,随着时间的延长,两种载体的 EGFP 产量逐渐增加,并达到稳定水平(图2e、f)。CssDNA (+) 和CssDNA (-) 的EGFP荧光曲线相当,但 CssDNA (-) 达到稳定水平所需的时间更短,表明其表达速率比 CssDNA (+) 更快。
『 02 』CFE 系统中不同表达组分对 CssDNA 的影响
为了研究 CFE 系统中 CssDNA 的表达,接下来评估了不同成分对其表达的影响。结果发现,在添加了脱氧核苷三磷酸(dNTP)后,CssDNA 载体的表达显著增加(图1g)。这表明 dNTP 在 CFE 系统中促进了 CssDNA 的基因表达。
另外,还发现添加了 DNA 聚合酶抑制剂阿非迪霉素(Aphidicolin)后,CssDNA 载体的表达受到了抑制(图2h,i)。这表明 DNA 聚合酶的活性对 CssDNA 的表达起着重要作用,这些发现为进一步调控 CssDNA 基因表达提供了基础。
『 03 』CFE 系统中 T7 启动子区对 CssDNA 的影响
为了研究在 CFE 系统中 T7 启动子序列的作用,他们在 CssDNA(+) 和 CssDNA(-) 载体中分别添加了 T7 互补链(图3a)。结果显示,在 CssDNA(+) 中添加 T7 互补链并没有影响表达,而在 CssDNA(-) 中添加 T7 互补链显著增加了蛋白质表达(图3b,c)。T7 互补链对 CssDNA(-) 的表达影响显著,使其蛋白质表达水平增加了三倍。

图3 T7启动子区在CssDNA基因表达中的作用
同时,也比较了 T7 互补链对质粒载体的影响,结果显示 T7 互补链的添加对质粒表达没有影响。此外,当 T7 互补链和阿非迪菌素同时存在时,CssDNA(+) 载体的基因表达受到抑制,而对 CssDNA(-) 载体的抑制效果几乎消失。换句话说,T7 互补链对 CssDNA(-) 的促进作用不受阿非迪霉素的影响。
为了研究不同长度的 T7 互补链对 CssDNA(-) 基因表达的影响,他们又设计了 6 个不同长度的变体。结果显示,不同长度的 T7 互补链对 CssDNA(-) 基因表达都有促进作用,但荧光增强率相同(图3e)。
进一步验证表明,不同长度的 T7 互补链结合的 CssDNA(-) 都能转录出mRNA,而 CssDNA(-) 和 CssDNA(+) 本身的转录能力很小。通过量化转录的RNA量,发现 T7 互补链长度减小会降低 CssDNA(-)+T7 的转录能力。
同时,还发现与 CssDNA(-) T7 启动子外的其他区域互补的 DNA 链对基因表达无影响,只有包含部分 T7 启动子序列的 DNA 链会增强基因表达(图3i)。因此,在CFE系统中添加与 T7 启动子互补的 DNA链 是调控 CssDNA(-) 基因表达的有效方法。
『 04 』CFE系统中CssDNA载体的基因表达途径
综合上述结果,不难发现 CssDNA(+) 和 CssDNA(-) 载体的表达过程与 DNA 合成有关。然而,CssDNA(-) 载体的表达途径与 CssDNA(+) 有所不同,可能涉及直接的转录机制。
为了验证这个假设,他们设计了一系列实验,使用不同浓度的 CssDNA 载体,并检测相应的 EGFP 表达情况。在实验中,他们使用了阿非迪霉素抑制 DNA 复制以及 T7 互补链模拟 DNA 复制的方法来模拟 CssDNA 表达中间过程,使表达途径更加明确。
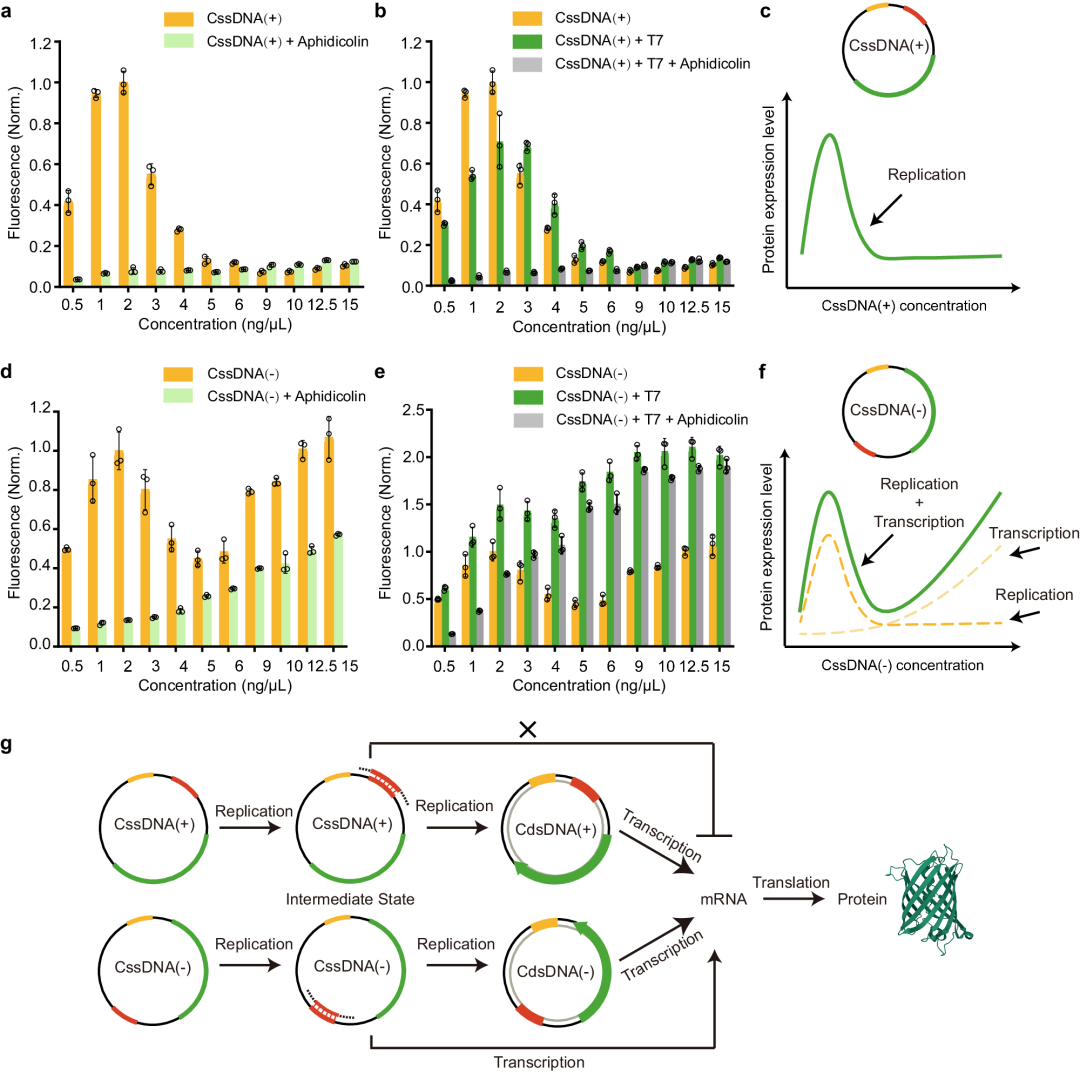
图4 两种CssDNA载体在CFE体系中的基因表达过程
结果显示,在 CssDNA(+) 载体中,随着载体浓度的增加,EGFP 的产量最初增加,然后减少。当载体浓度为 2ng/μL 时,EGFP 产量达到最大。然而,当 CssDNA(+) 载体浓度高于 2ng/μL 时,蛋白质表达降低,可能是由于资源共享效应的影响,即缺乏 DNA 合成底物来生成完整的双链DNA。
而添加阿非迪霉素会破坏 DNA 聚合酶活性,干扰单链 DNA 转化为双链DNA,因此无论 CssDNA(+) 载体浓度如何,蛋白质产量都显著降低。这表明在 CssDNA(+) 复制产生不完整环状双链 DNA 时,其表达可以忽略不计。
此外,还发现,无论向 CssDNA(+) 载体中添加任何浓度的 T7 互补链,都对 CssDNA(+) 基因表达没有显著增强作用。这与之前的结果一致,在T7互补链和阿非迪霉素共存下,EGFP 的产量与单独存在阿非迪霉素时一样低。
这些进一步证明了通过 DNA 复制完成的双链 DNA 合成是 CssDNA(+) 载体基因表达的必要条件,随后是 mRNA 转录和蛋白质翻译。换言之,CssDNA(+) 的蛋白质表达需要完整的互补链作为转录模板,似乎是 CssDNA(+) 基因表达的唯一途径。
『 结语 』
总之,这项研究不仅为合成生物学提供了新的基因调控工具,也为理解和利用单链 DNA 在生物系统中的行为提供了新的视角。通过 CssDNA,研究人员能够设计出更为复杂和精细的基因调控网络,这对于开发新的生物技术和生物医学应用具有重要意义。