浙大团队开发出「三组分LNP」,可实现真正意义上的mRNA靶向递送,无外溢风险!
mRNA治疗技术在治疗与蛋白质相关的广泛疾病方面展现出巨大潜力。然而,现有的mRNA载体在实现特定器官的mRNA积累和翻译方面存在挑战,尤其是在减少非目标器官(如肝脏)的积累方面。
已经尝试了不同的方法来实现肺部选择性的 mRNA 递送,包括选择性器官靶向(SORT)策略、典型LNPs的脂质结构调整和吸入方式等。
然而,吸入方法通常会导致昂贵的 mRNA 负载纳米颗粒利用率低。虽然在肝外的 mRNA 翻译方面取得了一些进展,但前两种方法中纳米颗粒在肝脏积累方面仍然存在问题。
因此,有必要重新评估现有的 LNP 系统,以确保其具有真正的靶向性能。经典四组分 LNPs 中胆固醇促进脂蛋白包裹,增强与肝细胞的相互作用。磷脂有助于制剂的结构稳定性和内体逃逸过程。然而,胆固醇和磷脂对于LNP的功能并非必需。
所以,重新配制 LNP 以实现真正的靶向递送,同时在目标器官中积累和翻译 mRNA 是有希望的途径。

2024年7月5日,浙江大学药学院刘帅、顾臻和平渊团队在《Nature Communications》发表了一篇研究文章,设计出了酯芯可降解的阳离子脂质库(nAcx-Cm),并开发了三组分 LNP,实现了真正的肺部 mRNA 积累和翻译,从而推进mRNA治疗技术的发展。
『 01 』设计用于 mRNA 递送的可降解酯芯阳离子脂质
具体来说,他们设计了一个可降解的核心-胺-尾配方,并使用简便的无溶剂一锅法合成了基于酯核的可电离阳离子脂质组合库(nAcx-Cm)。其中,n表示一个分子中的酯基数量(图1a、b),nAcx代表不同的丙烯酸酯核心,m代表脂质中不同的疏水烷基链。
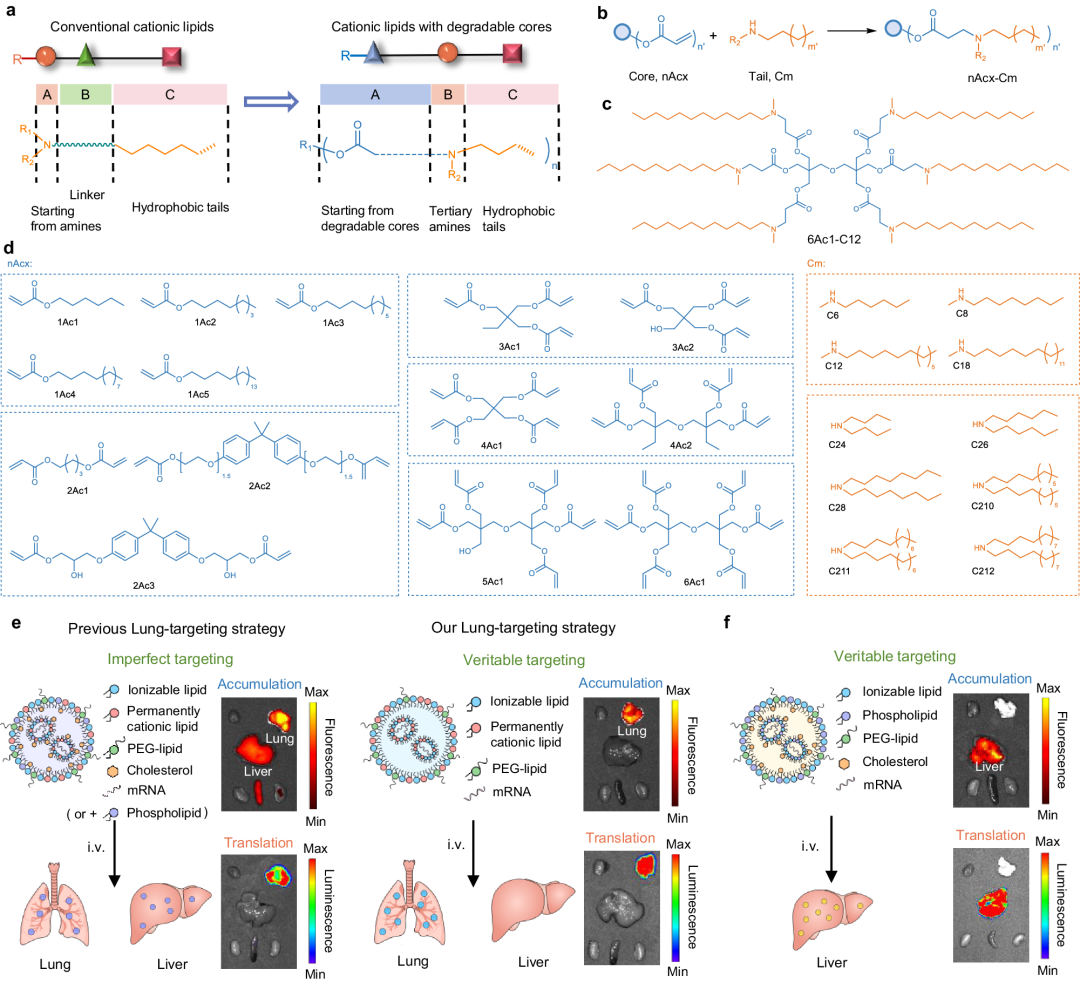
图1 设计了酯芯-胺-尾可电离脂质组合库用于 mRNA 靶向递送
随后,14种可降解酯芯和10种疏水尾分子进行迈克尔反应,得到了140种不同的nAcx-Cm脂质库。这些脂质具有可控数量的酯基和疏水尾,以及可变的支链及链长(图1c、d)。通过组分优化,实现了真正的器官靶向mRNA递送(图1e、f)。
『 02 』nAcx-Cm LNP 筛选可增强mRNA 递送
转染能力与载体化学结构和纳米制剂密切相关。通过正交试验优化了 nAcx-Cm 等成分 LNP 制剂在卵巢癌细胞系(IGROV1)中的效率,并在之后的第二轮体内筛选中,得到最佳配方 B-2,其nAcx-Cm/DOPE/胆固醇/DMG-PEG2000 摩尔比为15/20/25/2。
随后发现,nAcx-Cm 脂质中的分支数和尾部种类对 LNP-mRNA 效率有显著影响。多分支数(4~6)的脂质表现优于少分支数(1~3)的脂质,而只有单尾的脂质比有双尾的脂质表现更好。
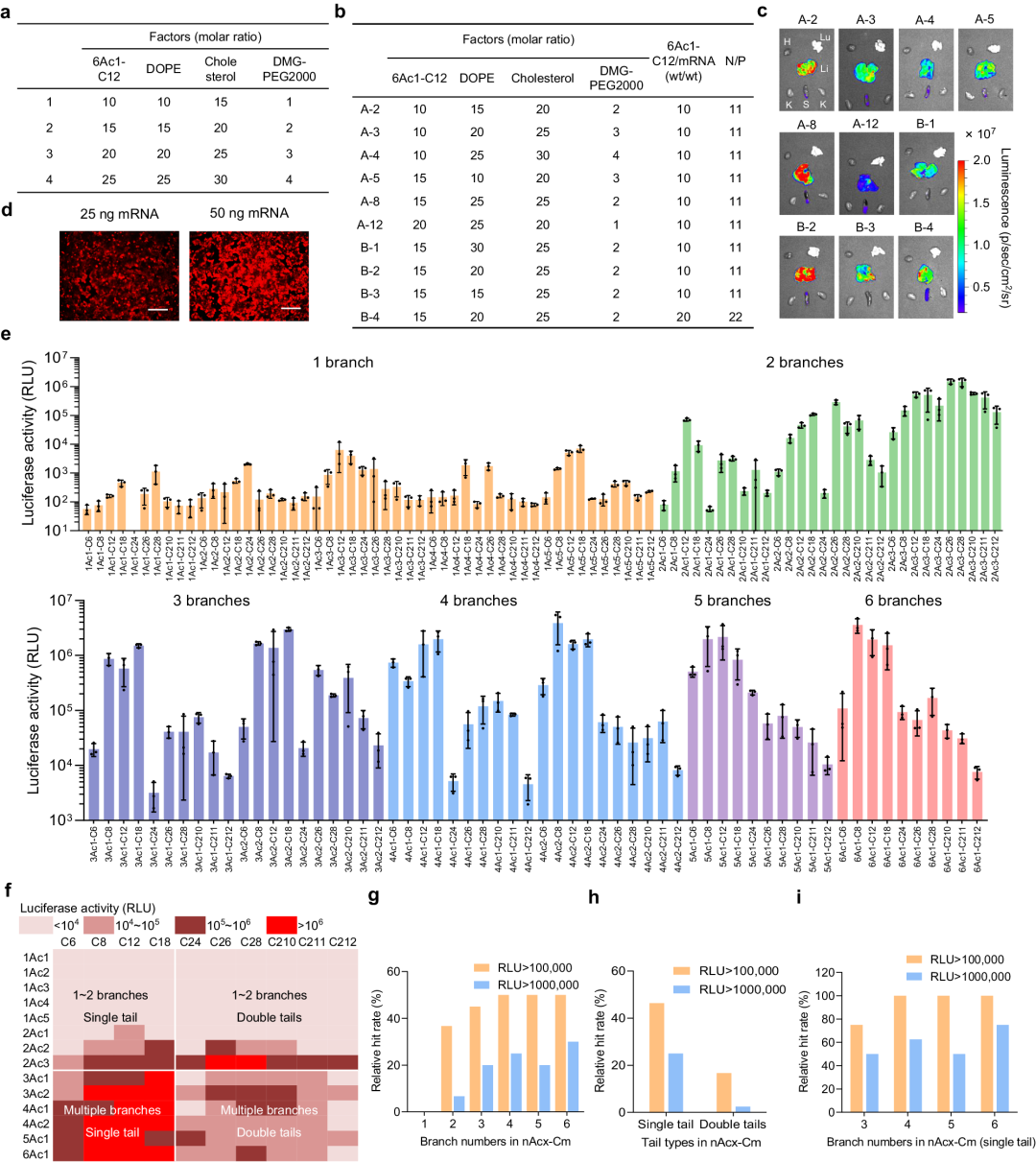
图2 用于 mRNA 传递的阳离子脂质的 LNP 优化和构效关系 (SAR) 研究
此外,在多分支和单尾的脂质中,当RLU强度超过100,000时,命中率达到100%。所有这些 LNP 都表现出低细胞毒性,水解实验证实了脂质的可降解性。这些结果表明,nAcx-Cm脂质在体内mRNA递送方面具有巨大潜力,并为进一步研究提供了基础。
『 03 』nAcx-Cm LNPs 解决了 mRNA 传递过程中的多种生理障碍
尽管已经设计了许多 LNP,但大多数都表现出有限的内体逃逸能力。此外,需要解决稳定性和 mRNA 释放曲线以增强递送。
nAcx-Cm LNP 的粒径约为100nm,令人鼓舞的是,6Ac1-C12 LNP 在 4°C 下保存 30 天后仍保持稳定,这有可能缓解 mRNA 药物冷链运输的挑战。相反,6Ac1-C212 LNP 在 30 天的保存过程中解离,突显了单尾分支在保持稳定性方面的有利作用(图3b,c)。
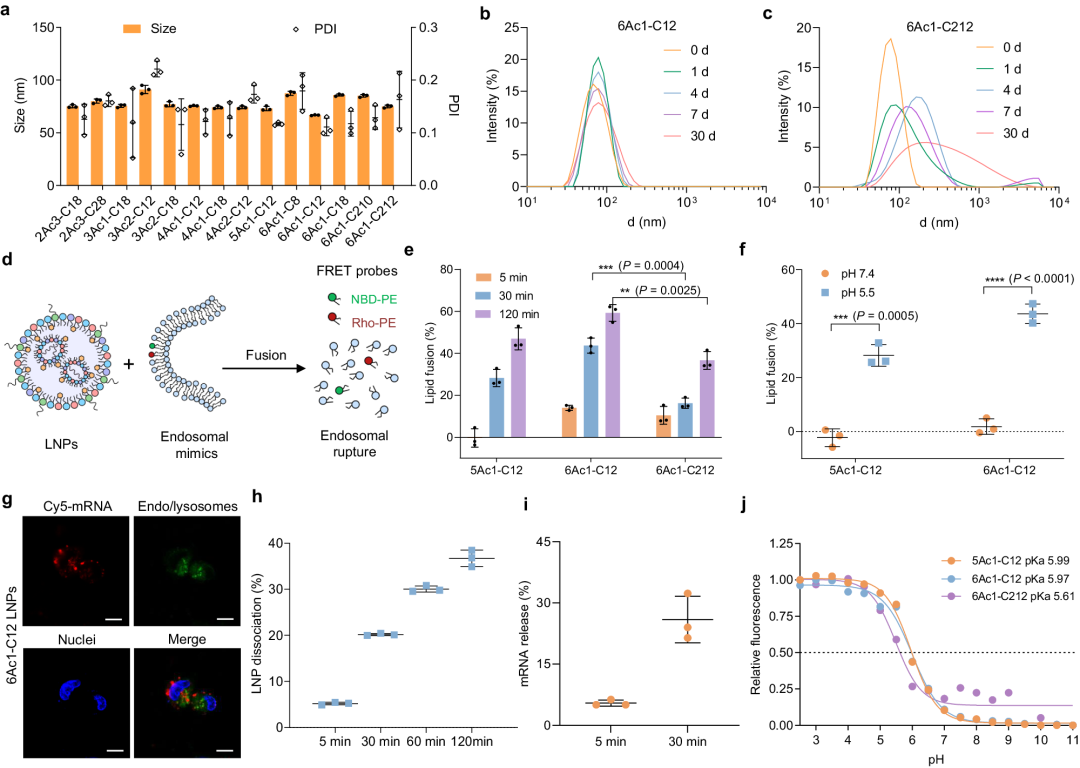
图3 nAcx-Cm LNPs 表现出优异的稳定性、内体逃逸和 mRNA 释放功能
为评估nAcx-Cm LNP的内体逃逸能力,他们接下来利用 FRET 分析了脂质融合和内体膜破坏。采用了两种FRET探针,Rho-PE和NBD-PE,将其掺入内体模拟脂质体中。脂质融合后,距离增加导致 NBD 信号增强,表明 6Ac1-C12 LNPs 的内体膜破裂能力高于 6Ac1-C212 LNPs(图3e)。
6Ac1-C12 LNPs 在生理条件下几乎不会发生膜融合,保证了它们在体内的生物相容性(图3f)。通过荧光成像观察到 6Ac1-C12 LNPs 的内吞作用和内体逃逸,随后 mRNA 从 LNP 中高效释放出来并翻译成蛋白质。
此外,nAcx-Cm LNPs 的稳定性良好,其 pKa 值约为 6.0,表明 mRNA 可以快速从内体中逸出并释放到细胞质中进行翻译。
『 04 』nAcx-Cm LNPs 的脂质结构和成分控制器官靶向 mRNA 翻译
接下来,他们通过体外筛选选出11种 nAcx-Cm 脂质,并评估其体内表现。结果显示,6Ac1-C12 脂质在全身给药后可实现高达98%的肝脏 mRNA 表达(图4c,d)。与已批准的 LNP 相比,优化的 LNP 在静脉或肌肉注射后表现出更高或相当的 mRNA 表达。此外,较中等尾长的脂质有助于提高 mRNA 递送效果。
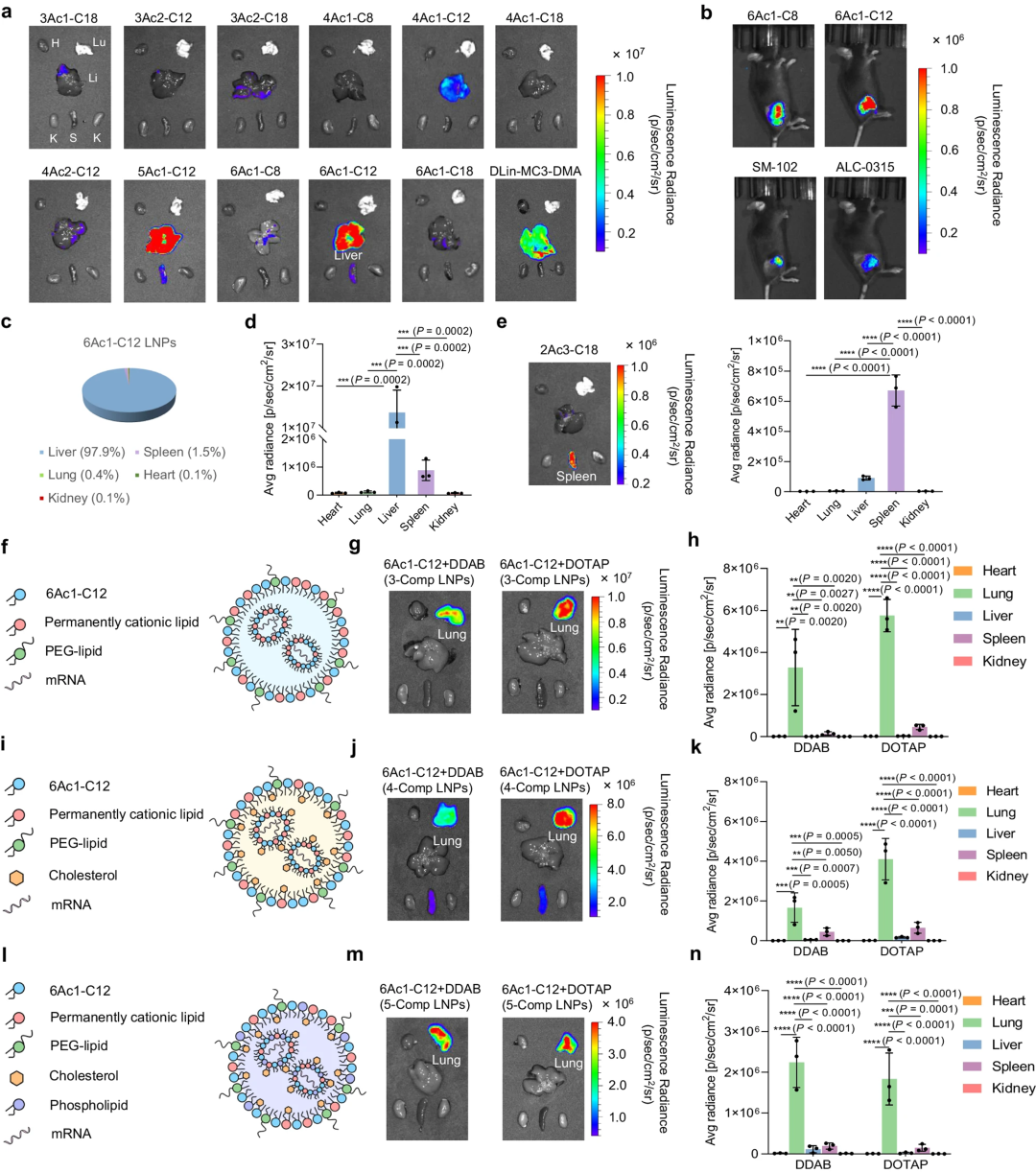
图4 LNPs中的脂质结构和成分调节控制器官特异性mRNA翻译
随后,他们研究了可降解酯芯在器官靶向中的作用。具有两个分支2Ac3-C18 LNPs 在体内表现出良好的脾脏靶向性,有助于免疫治疗应用。与之前的研究结果一致,含有 DOTAP 的 6Ac1-C12 LNPs 在腹膜内和静脉注射后促进了胰腺和肺部的 mRNA 表达。
此外,还设计了三组分(3-Comp)LNP,去除了磷脂和胆固醇,能够增强肺部递送。这种创新的 3-Comp 策略在其他 LNP 系统中也表现出多功能性。与 4-Comp 或 5-Comp 相比,简化的 3-Comp Lung LNP 具有更高的效果(图4f-n)。这些结果显示了去除原始成分实现真正的器官靶向mRNA递送的潜力。
『 05 』重新配制 LNP,用于同时进行器官靶向mRNA 积累和翻译
他们假设 LNP 的肝向性源于其内在的成分相关特性,通过重新调节 LNP 成分,可能实现真正的肝以外靶向递送。因此,从包含 DOPE、胆固醇和 PEG 脂质的经典辅助脂质开始,制备出 6Ac1-C12 LNPs,这些 LNPs 能够实现在肝脏中的靶向积累和蛋白质表达。与之前主要在肝细胞中摄取的 LNPs 相比,nAcx-Cm LNPs 能够进入内皮细胞和库普弗细胞。
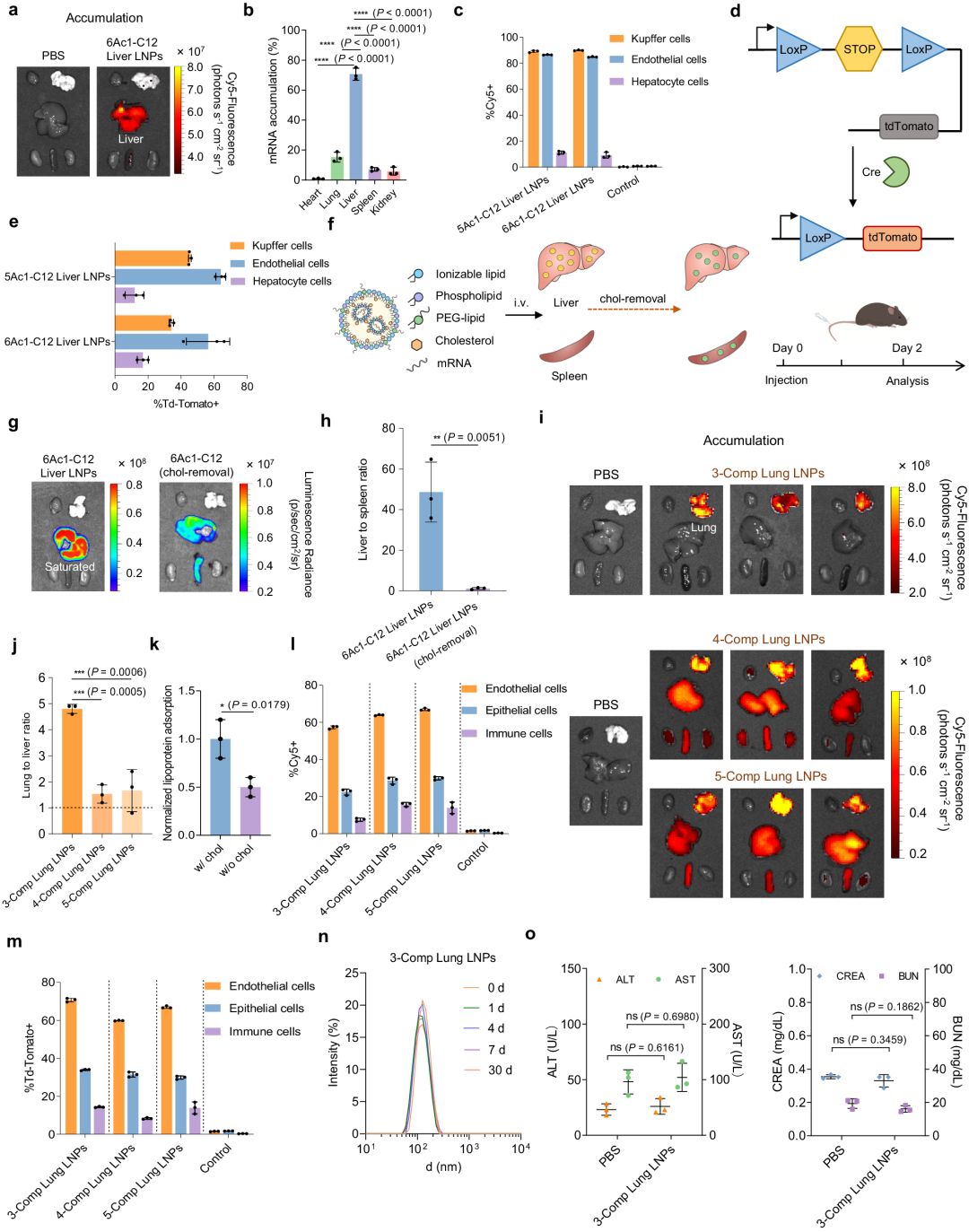
图5 LNP成分调整使器官靶向mRNA的积累和翻译同时实现
随后,他们使用含有 Lox-Stop-Lox 盒的 Cre-LoxP 小鼠模型,通过递送 Cre mRNA ,验证了细胞类型特异性的 mRNA 翻译能力。结果发现,6Ac1-C12 肝脏 LNPs 和 5Ac1-C12 肝脏 LNPs的 mRNA 表达主要发生在内皮细胞中,转染率约为60%。
含有胆固醇的 LNP 通常具有对肝脏的亲和力,因此,他们从 6Ac1-C12 肝脏 LNPs 中去除胆固醇,会导致肝脏中 mRNA 表达降低,同时增加向脾脏的输送,从而降低肝脏靶向性(图 5f-h)。
3-Comp Lung LNPs 不仅在肺部表现出良好的靶向性,还可以进入内皮细胞和免疫细胞(图5m),并在这些细胞中进行 mRNA 的翻译。
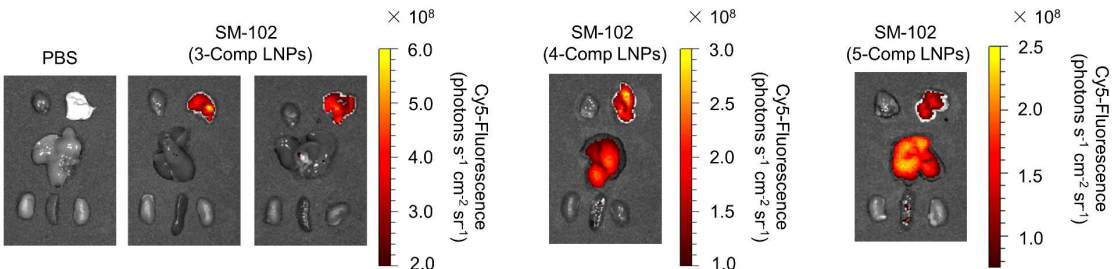
基于SM-102的3-Comp LNPs验证,防止递送外溢
此外,他们还在 SM-102 脂质中验证了这一三组分策略,结果保持一致,证明了使用 3-Comp LNPs 进行肺靶向蓄积的优越性。而去除胆固醇并不影响 LNP 的稳定性,并且在体内显示良好的耐受性。因此,3-Comp Lung LNPs有望成为治疗肺部相关疾病的有效治疗选择,并且副作用较小。
『 结语 』
综上,该研究团队成功地重新设计了 LNPs,通过去除胆固醇和磷脂,不仅保留了 LNPs 的功能,还赋予了真正的靶向能力。这种创新的LNP技术为mRNA治疗开辟了新的可能性,特别是在实现肺和肝的靶向递送方面。