Science重磅 | Recode开发肺部干细胞SORT-LNP,介导长达1.8年的基因编辑效果!
基因编辑技术被认为是医学领域的一项革命性进展,能够为多种疾病提供持久的治疗方法。
尽管靶向递送至分化细胞,如肝细胞和T细胞取得了进展,但基因编辑在体内递送到干细胞仍具有挑战。
要实现持久的治疗反应,可能需要在组织驻留干细胞中进行编辑,以克服分化细胞中定期出现的修复 DNA 丢失。

2024年6月13日,Recode Therapeutics联合德克萨斯大学西南医学中心科学团队,在《Science》发表了一篇研究文章,利用 Lung SORT LNPs 递送系统,将腺嘌呤碱基编辑器(ABEs)mRNA/gRNA系统递送到肺部干细胞中,在囊性纤维化(CF)模型上实现高效基因修复和功能恢复。
/ 01 /Lung SORT LNP介导长达1.8年体内基因编辑递送
首先,将 SORT 特有的五组分5A2-SC8、DOPE、胆固醇、DMG-PEG 和 DOTAP 按一定的摩尔比溶于乙醇制备有机相(34:18:36:36:10用于体外研究;21.6:12:24:24 .4:40用于体内研究)。
水相为含 RNA 的柠檬酸缓冲液(pH=4)中,将水相与有机相以 3:1 的体积比快速混合,总脂质与 RNA 的重量比为 20:1,制备得到 Lung SORT LNPs RNA 递送系统。
为了研究 Lung SORT LNPs 将 mRNA 编码的 ABE 递送到肺干细胞的潜力,他们在 Ai14 LoxP-stop LoxP tdTomato(tdTom)报告小鼠中,静脉注射 LNP-Cre(2mg/kg,48小时后二次注射)。
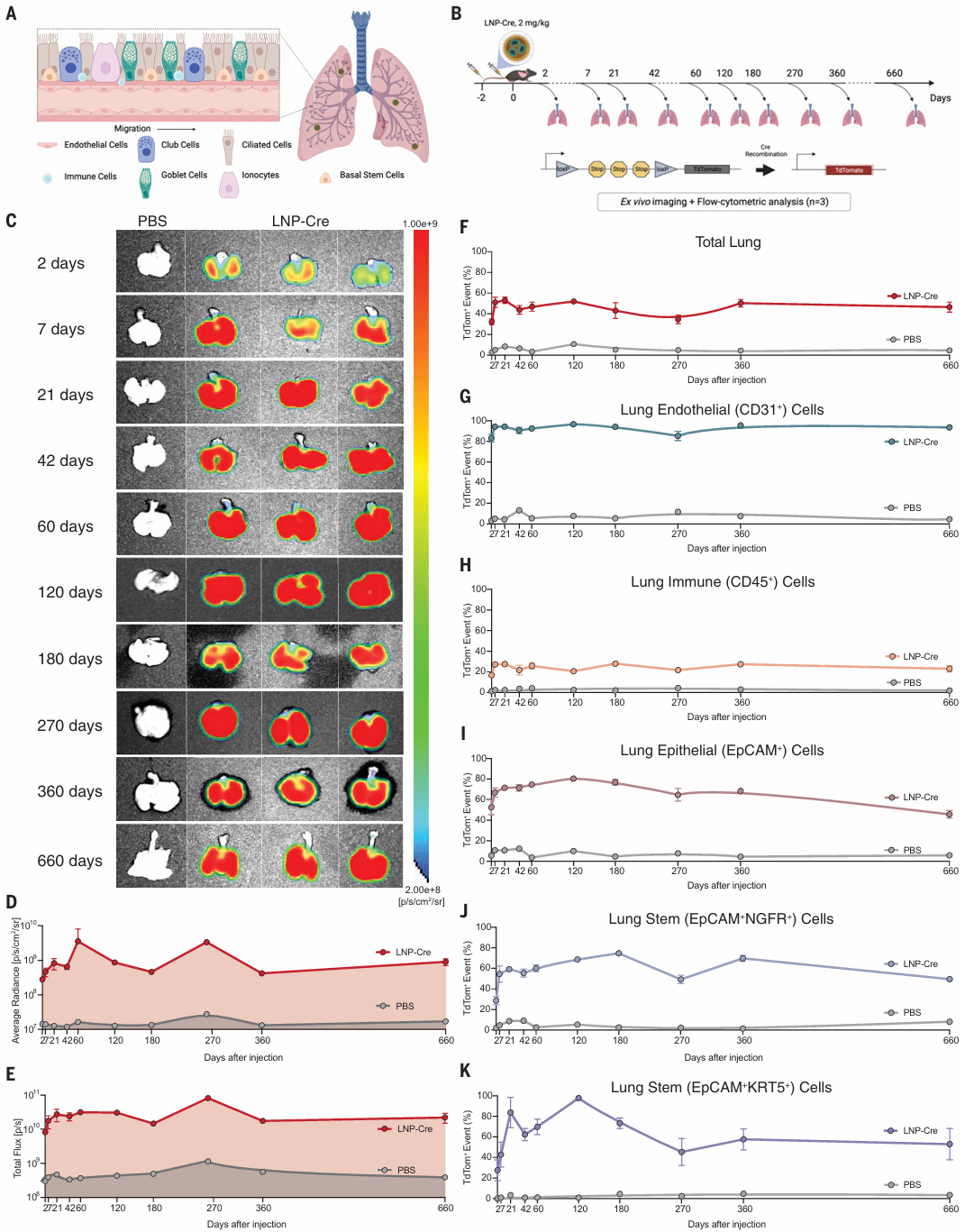
在小鼠肺部实现长达1.8年的体内基因编辑
结果发现,从 2 天到 660 天的多个时间点,发现 tdTomato 的表达在肺上皮细胞中保持了高度的持续性,超过 80% 的肺上皮细胞在整个实验期间保持tdTomato的表达。
特别是在肺干细胞中,tdTom表达的比例在早期达到高峰后,虽有所下降,但在长达1.8年的时间内仍保持较高水平,显示出基因编辑的长期效果。
/ 02 /对肺部多种细胞类型的长期编辑
通过荧光成像和组织切片分析,他们发现tdTom表达不仅局限于干细胞,还广泛分布在多种成熟的肺上皮细胞类型中。
包括大约 18% 的 AT1 细胞、20% 的 AT2 细胞、10% 的杯状细胞、6% 的纤毛细胞和 2% 的棒状细胞显示出编辑的迹象,这种编辑持续了长达360天。
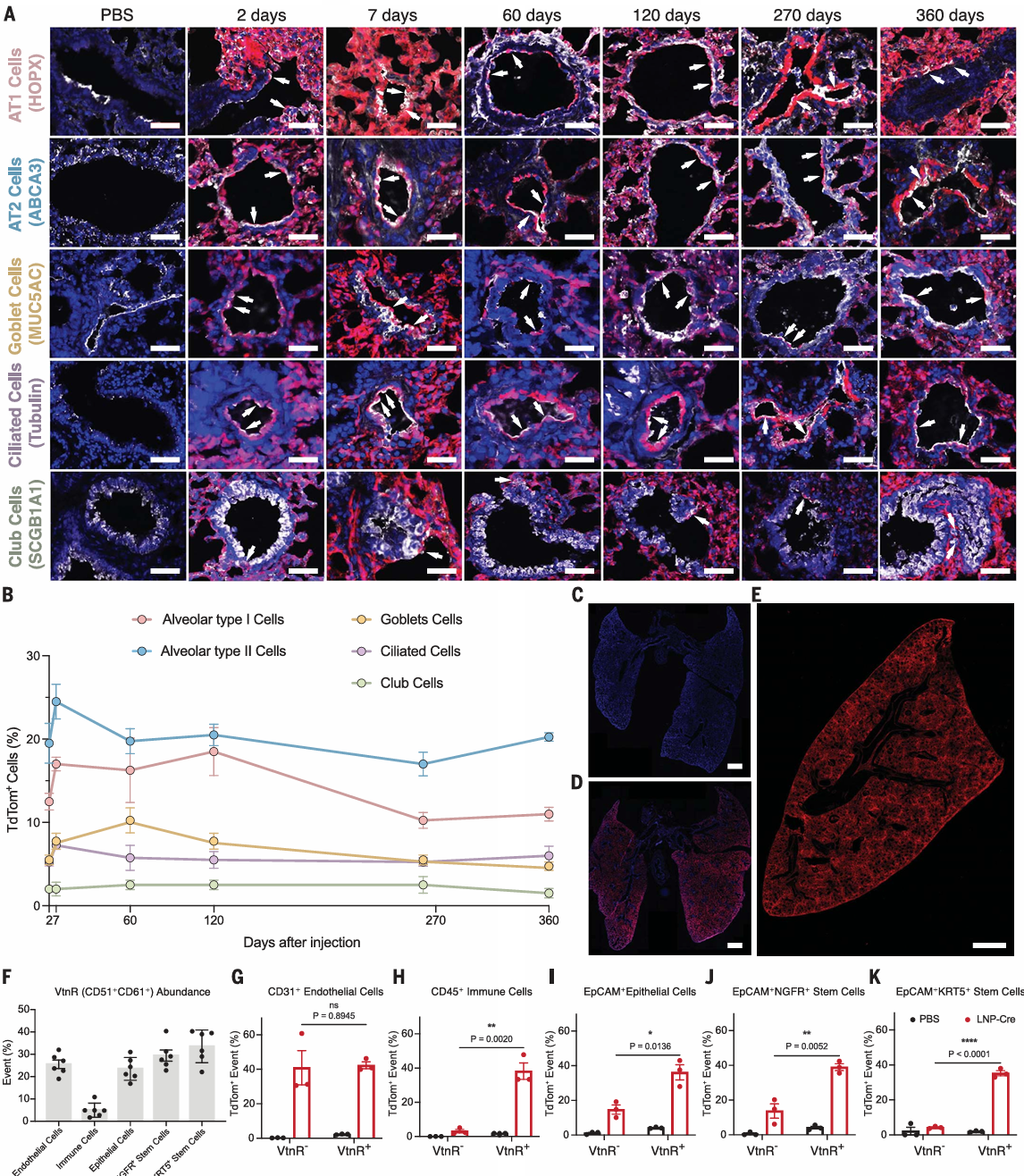
LungSORT LNPs介导的高效递送到不同类型的肺细胞,并增强了对表达vtnr的细胞的递送
此外,表达玻璃体连接蛋白受体(VtnR)、整合素 αVβ3 的肺细胞类型,显示出更高的基因编辑效率,这表明 VtnR 介导的摄取可能在肺细胞中促进了 Lung SORT LNPs 的内化和基因编辑复合物的递送
/ 03 /囊性纤维化(CF)疾病模型中的应用
为了评估 Lung SORT LNP 对遗传性肺病的治疗潜力,他们选择由 CFTR 突变引起的 CF 作为代表性模型。
在针对 CFTR 基因的 R553X-F508del复合杂合突变的 CF 患者源性支气管上皮细胞中(HBE),使用基因编辑 NG-ABE8e mRNA-sgR553X LNPs 进行治疗,实现了超过 95% 的 DNA 校正率,并且恢复了 CFTR 蛋白的表达和功能。
单独使用 LNP-ABE8e 递送,使核心糖基化的 CFTR 表达量增加了一倍,并使完全糖基化、成熟的 CFTR 表达量增加了 5.5 倍。
与 CFTR 调节剂 Trikafta(针对F508del突变CF患者的标准治疗)的联合治疗时,进一步使完全糖基化的 CFTR 表达量增加了7.8倍。
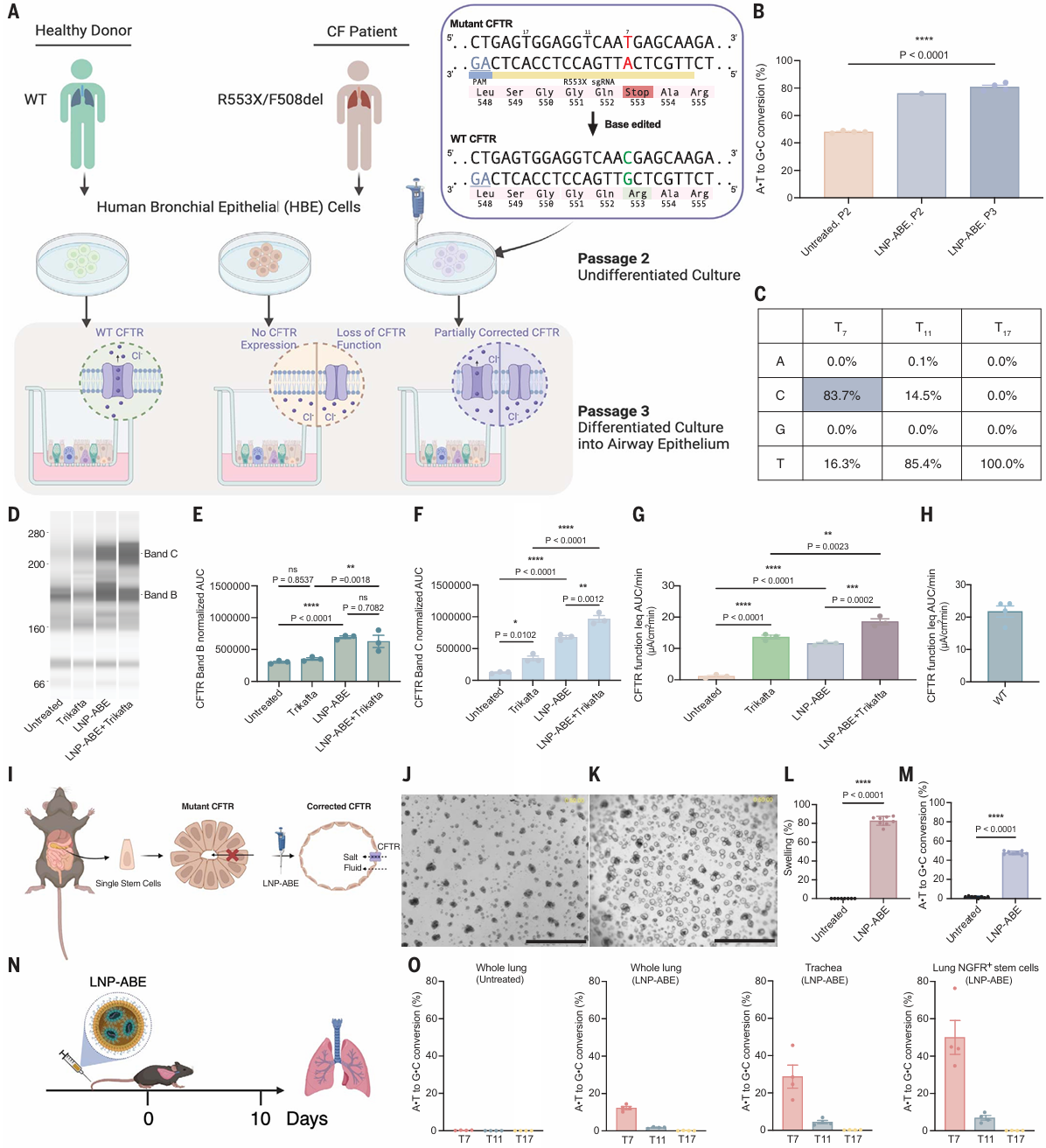
在患者肺基底细胞中衍生的HBE细胞和CF小鼠模型中实现高效腺嘌呤碱基编辑
随后,他们利用携带人 R553X 杂合突变的 CF 小鼠,评估了 LNP-ABE 介导的基因编辑校正。
通过静脉注射 LNP-ABE,10 天后收集小鼠的肺部组织。分离提取了肺干细胞的基因组DNA,并进行了 PCR 扩增和 NGS 分析。
结果发现,在肺干细胞中,目标 T7 位点的校正率达到了 50.0%,整体肺部组织中为 12.2%,气管中则为 28.7%。这些数据强烈表明 LNP-ABE 能够在小鼠的肺干细胞中,有效校正导致疾病的特定基因突变。
安全性方面,在实验期间,LNP-ABE 治疗未对小鼠的肾脏和肝脏功能造成影响,也未引起组织损伤,显示出良好的安全性和耐受性。
/ 结语 /
总之,这项研究表明,通过LNP-mRNA系统递送基因编辑药物到目标细胞,可以高效且精确地进行基因编辑。为了实现持久的治疗效果,需要在组织驻留的干细胞中进行编辑,以克服分化细胞中DNA修复的丢失。
基于Lung SORT LNP递送的ABE碱基编辑技术成功修复了小鼠肺干细胞中的突变,并恢复了囊性纤维化相关蛋白的表达和功能,表明在肺干细胞中进行基因编辑对于遗传性肺疾病治疗非常有潜力,也有助于开发持久性治疗方法。